Что такое изотоп?
Что такое изотоп?
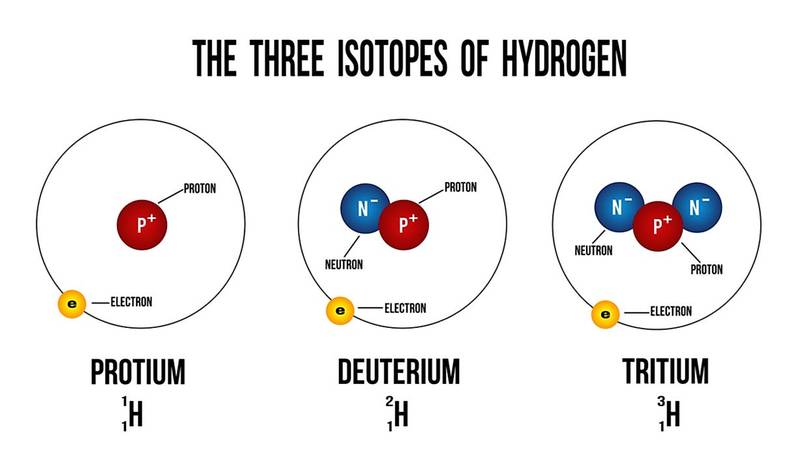
Изотопы - это атомы одного и того же элемента, которые имеют одинаковое количество протонов, но разное количество нейтронов. Их атомные номера одинаковы, но их массовые числа различны. Массовые числа всегда обозначаются через A, тогда как Z относится к атомным номерам элементов. Атомный номер символизирует количество протонов в ядре атома и используется для определения положения элемента в периодической таблице. Массовое число атома - это число нейтронов в его ядре. Изотопы элементов обладают различными физическими свойствами из-за различий в их атомных массах. Из-за этой разницы такие изотопы имеют разную плотность, а также температуру плавления и кипения. Однако изотопы элемента всегда обладают очень схожими химическими свойствами. Сходство происходит потому, что в химических реакциях используются только электроны, а не нейтроны или протоны.
История изотопов
Радиохимик Фредрик Содди впервые предположил о существовании изотопов в 1913 году после проведения исследований, связанных с распадом радиоактивных цепей. Во время своих экспериментов Содди понял, что между свинцом и ураном существует сорок различных видов, но периодическая таблица может вместить только 11 атомов. После того, как химические тесты, проведенные для разделения некоторых из этих элементов, не увенчались успехом, он предположил, что более одного типа атомов могут занимать одинаковое положение в периодической таблице, и назвал их изотопами.
Примеры изотопов
Хлор содержит два основных изотопа: хлор-35 и хлор-37. Чтобы прийти к такому выводу, ученые обнаружили, что в веществе хлора существуют общие пропорции каждого из этих изотопов, и именно поэтому соотношения используются для выражения разницы в количестве. Эти соотношения полезны при расчете относительных процентов и относительных атомных масс. Другие примеры изотопов включают углерод (изотопы углерода-12 и углерода-14), кислород (кислород-16 и кислород-18) и фосфор (фосфор-31 является основным изотопом, хотя также существуют определенные количества фосфора-32). Изотопы этих соединений считаются стабильными, и большинство из них имеют только два изотопа. Однако есть несколько элементов, которые имеют только один изотоп, и к ним относятся фтор, бериллий, мышьяк, иттрий, золото, алюминий, йод, марганец, натрий и ниобий.
Очистка изотопов
Есть три основные области, где применяются изотопы. Первый - это разделение изотопов. Разделение способствует максимизации свойств атомов по мере необходимости. При разделении более легких элементов, таких как дейтерий и кислород, применяется метод газовой диффузии. Разделение тяжелых элементов, таких как уран и плутоний, происходит с помощью масс-спектрометрии.
Применение изотопов
Первое применение изотопов - это их использование археологами для датирования по углероду. Изотопы бывают двух видов: стабильные и радиоактивные изотопы. Стабильные изотопы содержат равную комбинацию протонов и нейтронов и как таковые не подвергаются распаду. С другой стороны, радиоактивные изотопы имеют нестабильные ядра и, таким образом, подвергаются распаду. Радиоактивный распад может длиться до 5730 лет, как, например, у элемента углерода. Археологи используют этот компонент изотопов для определения возраста предмета, найденного при археологических раскопках.